荧光染料及其荧光标记技术一直是生物领域常用的产品和技术,我司拥有的标记荧光的波长从300nm到700nm,除了常见的FITC、FAM、罗丹明、AFC、AMC、Rox、Sulforhodamine 101、5-TAMRA、EDANS Texas Red、5-Tamra、5-lodoacetamido fluorescein等荧光标记染料外,还研究Cy3,Cy5, BODIPY各种衍生物等特色产品。用NHS活化的荧光染料可以用于蛋白、多肽、DNA、抗体等标记。
一、什么是荧光标记?
荧光标记所依赖的化合物称为荧光物质。荧光物质是指具有共轭双键体系化学结构的化合物,受到紫外光或蓝紫光照射时,可激发成为激发态,当从激发态恢复基态时,发出荧光。荧光标记技术指利用荧光物质共价结合或物理吸附在所要研究分子的某个基团上,利用它的荧光特性来提供被研究对象的信息。荧光标记的无放射物污染,操作简便等优点,使得荧光标记物在许多研究领域的应用日趋广泛。
二、荧光标记的作用
荧光标记物质在蛋白的功能研究、药物筛选等领域也有着广泛的应用。人们利用利用荧光标记的多肽来检测目标蛋白的活性,并将其发展的高通量活性筛选方法应用于疾病治疗靶点蛋白的药物筛选和药物开发(例如,各种激酶、磷酸酶、肽酶等)。因此,多肽的荧光修饰,同样是多肽合成领域的重要内容。
三、荧光标记的位点
荧光标记物质可以直接和多肽的N端直接相连(如异硫氰酸荧光素的连接, 通常在多肽的N端和异硫氰酸荧光素直接插一个氨基乙酸或者β-丙氨酸。),或者在C端和赖氨酸(或半胱氨酸)的侧链连接、或者在其它可以连接的位子连接。
四、荧光标记的举例
4.1 荧光标记FITC修饰
异硫氰酸荧光素(FITC)具有比较高的活性,通常来说,在固相合成过程中引入该种荧光基团相对于其他荧光素要更容易,并且反应过程中不需要加入活化试剂。
荧光标记FITC修饰的多肽通常主要有两种形式:
(1)在整条肽链N端接入FITC,并且在FITC之前接入一分子的Acp(6-氨基己酸),也称烷基间隔器。反应中FITC与肽链上裸露的-NH2反应,Acp的接入提供了六个碳的直链空间,大大降低了反应的空间位阻,提高了反应效率,降低了反应难度。其次,FITC还与多肽结构中的-SH,侧链-NH2反应,Acp的加入也降低了这种副反应发生的可能。此外,多肽在酸性环境条件下切割时,在N端接入FITC的多肽需要经历环化作用来形成荧光素,这种过程通常都会伴随最后一个氨基酸的切除,而烷基间隔器Acp的接入就避免了这一情况的发生。
(2)在整条肽中的某个Lys侧链接入FITC,Lys侧链为末端为-NH2的四碳直链烷基,直接起到了降低空间位阻的作用。这种修饰方式能够灵活的在整条肽中任何位置进行FITC修饰,而不仅仅局限于末端。
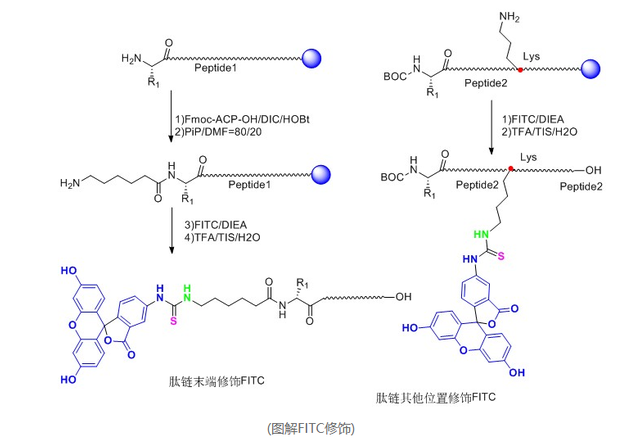
(图解FITC修饰)
4.2 荧光标记AMC修饰
7-氨基-4-甲基香豆素(AMC)是一种应用广泛的荧光标记试剂,例如,酶的痕量测定,酶的鉴定,激光染料的制备等多种用途,此外,C端用香豆素修饰的泛素分子也是研究蛋白质泛素化过程的重要探针。
与其他荧光染料不同的是,AMC修饰多肽分子是从C端进行:
AMC与肽链C端第一个氨基酸反应;
固相合成整条肽链(从第二个氨基酸开始),并且保留整条肽链的侧链保护基和最后一个氨基保护基;
液相缩合AA-AMC与全保护的肽链;
(4)切除保护基,完成肽链的修饰。
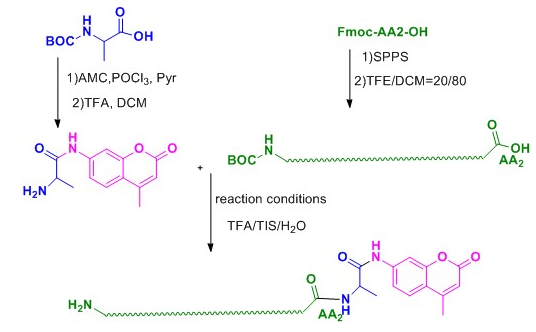
(图解AMC修饰)
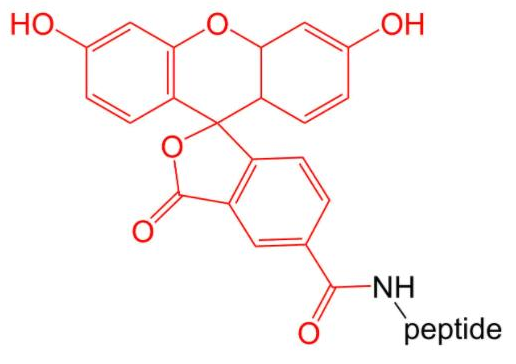
4.3 荧光标记5-FAM修饰
通常用于激光共聚焦显微镜和流式细胞技术的运用。
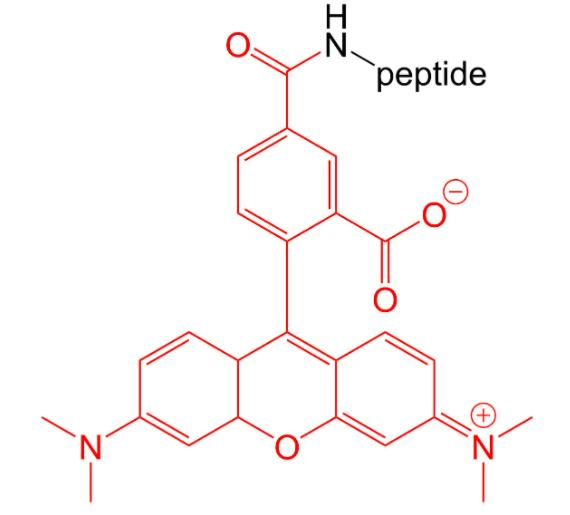
4.4 荧光标记Rhodamine B(罗丹明 B)修饰

罗丹明B是众多罗丹明染料中的一种,用于荧光测定。
4.5 荧光标记5-TAMRA 修饰
5-TAMRA是用于标记肽和蛋白质的最流行的橙色荧光团之一。
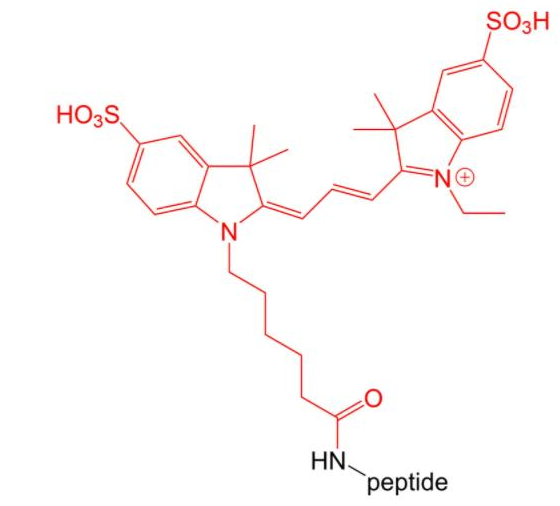
4.6 荧光标记Cy 3和 Cy 5修饰
Cy3 and Cy5 是高消光系数的染料。因此,它们特别适用于细胞内敏感的多肽定位实验。它们的缺点是在多肽合成的环境中非常的不稳定,因此合成的量相对低。
Cy3-Peptide
最后
以上就是英勇盼望最近收集整理的关于荧光标记多肽FITC/AMC/FAM/Rhodamine/TAMRA/Cy3/Cy5/Cy7-Peptide的全部内容,更多相关荧光标记多肽FITC/AMC/FAM/Rhodamine/TAMRA/Cy3/Cy5/Cy7-Peptide内容请搜索靠谱客的其他文章。








发表评论 取消回复