海洋氨氧化古菌的营养能量策略决定其生物地理学分布格局

题目:Alternative strategies of nutrient acquisition and energy conservation map to the biogeography of marine ammonia- oxidizing archaea
DOI:https://doi.org/10.1038/s41396-020-0710-7
期刊:ISME Journal [IF: 9.18]
第一作者:Wei Qin (秦玮),Yue Zheng (郑越)
通讯作者:Wei Qin (秦玮),Feng Zhao (赵峰),Anitra E. Ingalls
氨氧化古菌(Ammonia-oxidizing archaea,AOA)在地球上分布广泛数量巨大,是海洋和陆地生态系统氮循环的主要驱动者。同时,AOA在全球碳固定、温室气体排放以及维生素B12代谢中也扮演着重要角色,被誉为环境微生物研究的“明星物种”。自2005年美国华盛顿大学David Stahl实验室分离出第一株AOA纯菌株(Nitrosopumilus maritimus SCM1)以来,科学家又陆续在土壤、热泉、河口、海岸带和远洋等不同生境中获得约40余个AOA的纯菌株或富集物。然而,从遗传上这些AOA的进化演变规律尚不明确,从生理上这些AOA在不同生境的适应机制仍不清楚。
美国华盛顿大学(University of Washington)、中国科学院城市环境研究所等22个科研单位的学者共同合作,汇集了44株氨氧化古菌(其中30株源自先前报道,14株来自该论文的研究),涵盖陆地、高温热泉到深海万米海沟的不同生境(图1)。综合实验室长期进化实验、纯菌株组学挖掘、环境宏基因组模型分析,从时间尺度和空间尺度讨论了氨氧化古菌的环境适应策略,拓展了AOA参与的生物地球化学循环的知识体系,为其环境功能强化提供了科学支持。
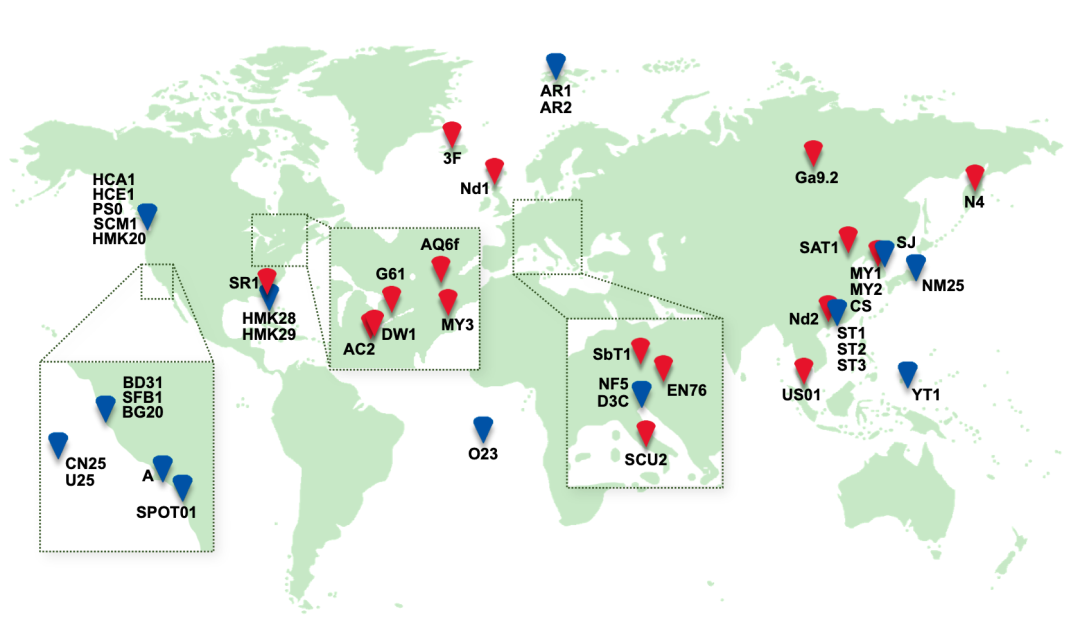
图1 本研究中44株氨氧化古菌的全球分布图(蓝色代表海洋来源,红色代表陆地来源)
1. 氨氧化古菌十年进化实验
模式菌株N. maritimus SCM1自2005年被分离,在长达十余年的传代进化过程(约3000代)中,SCM1生长代时从约2天逐渐增快到约1天(图2)。通过每隔约五年重测序结果发现,总共18个基因发生了单碱基变异,其中11个为非同义突变,其突变速率为4.310-9 per site per generation,远高于海洋中另外一类高丰度微生物——原绿球藻(Prochlorococcus)的突变速率(~10-10 per site per generation)。其中,两个重要变异位点发生在NirK亚硝酸盐还原蛋白(Nmar_1667)和AMT低亲和力氨转运蛋白(Nmar_0588)上(图3)。通过对比突变前后NirK蛋白参与的氨氧化反应中间产物,一氧化氮(NO)的生成(图2),发现变异后菌株的NO生成速率显著提升,这可能是导致变异后菌株生长速率大幅提升的原因。低亲和力氨转运AMT蛋白的变异,则反映由于人工海水培养基中氨浓度远高于实际海洋环境中氨浓度,因此菌株对氨亲和力下降。鉴于氨氧化古菌目前仍无法进行遗传操作,本研究长达十余年的进化实验,从单碱基水平论证了遗传信息和生理功能的潜在关系,揭示了氨氧化古菌对于不同氨环境的适应策略。
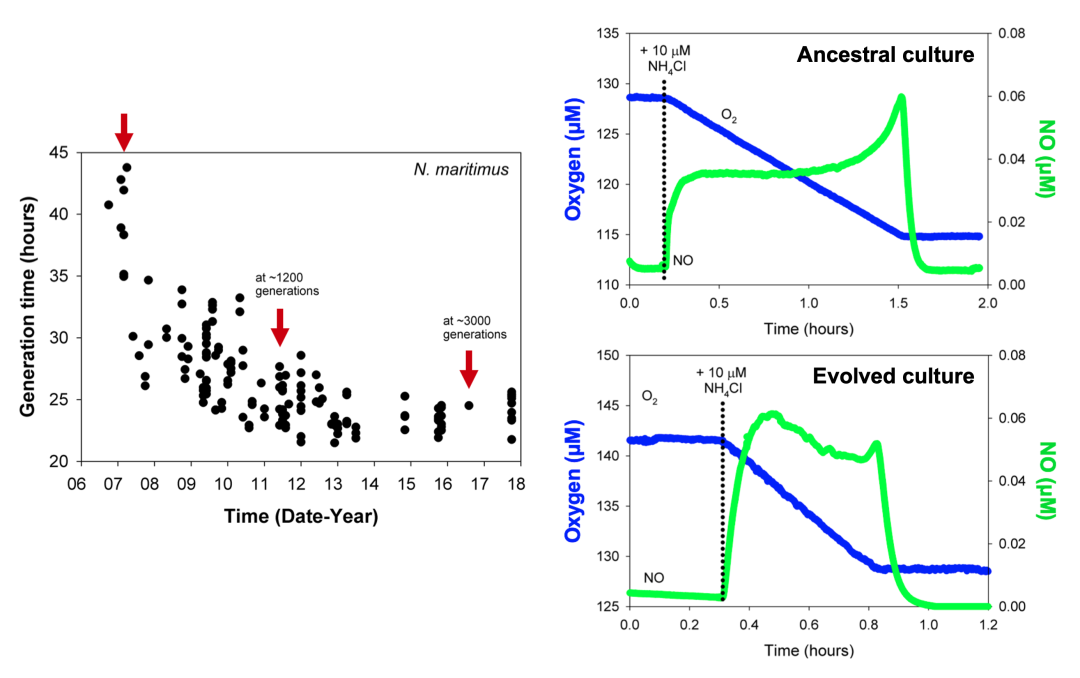
图2. 氨氧化古菌十年进化实验
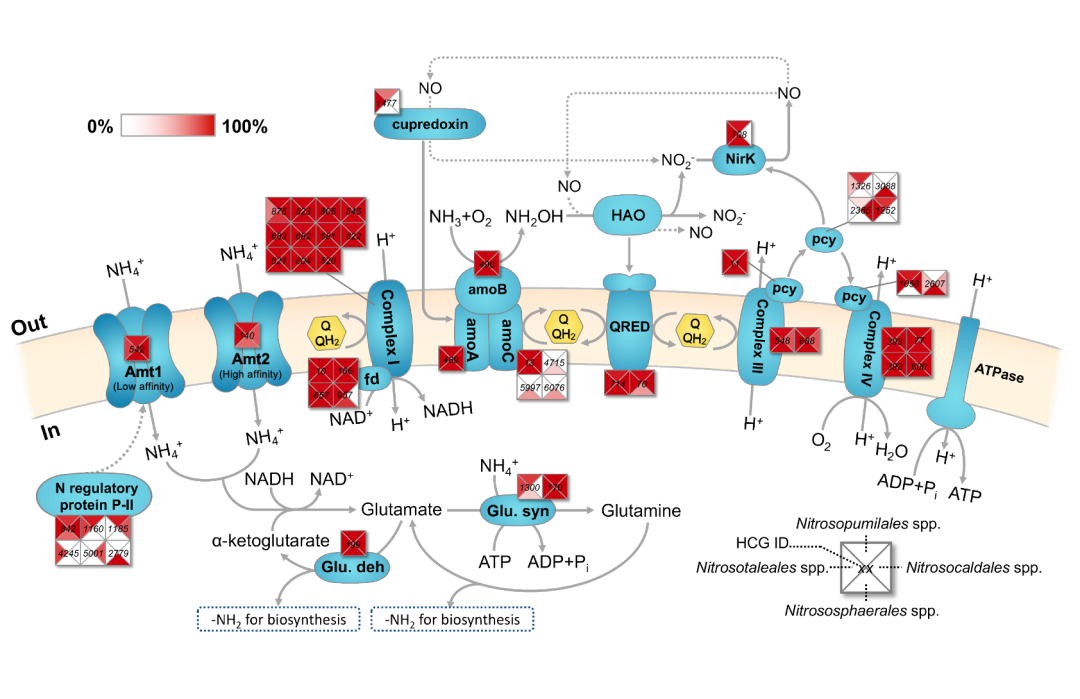
图3. 氨氧化古菌的氮代谢途径
2. 全球海洋尺度氨氧化古菌的物种分布特征
本研究根据进化距离,将海洋氨氧化古菌归为7个类群,代表河口、海岸带、表层海洋、深层海洋、深渊海沟等不同生境的优势类群。通过比对Tara和GOS海洋宏基因组数据库,对氨氧化古菌在全球海洋尺度的物种分布进行普查(图4)。我们发现Nitrosopumilus-like AOA在河口区域丰度最高,从近海岸到远海岸丰度逐渐减少。Nitrosopumilus (Ca. Nitrosomarinus)-like AOA在海岸带区域占主导,而Ca. Nitrosopelagicus-like AOA在远洋表层海水占主导。在远洋不同水层,WCB-AOA在中层带(250–1000 m)占主导,但在部分上升流海域WCB-AOA在表层海水中丰度也较高。
对于垂直空间分布,我们分析了贯穿表层到近万米深度的宏基因组样品。Ca. Nitrosopelagicus-like AOA在200m以上真光层丰度较高。WCB-AOA 从200m到2000m生境占主导,然后往更深海域4000m-8000m,Nitrosopumilus-like hadopelagic AOA逐渐增多。值得注意的是Nitrosopumilus-like AOA除了在近海岸物种分布中出现,在6000m-8000m深渊海域也大量存在,预示着其可能适应复杂的海洋生境条件。总体来说,不同海洋氨氧化古菌类群具有明显的生态位差异。
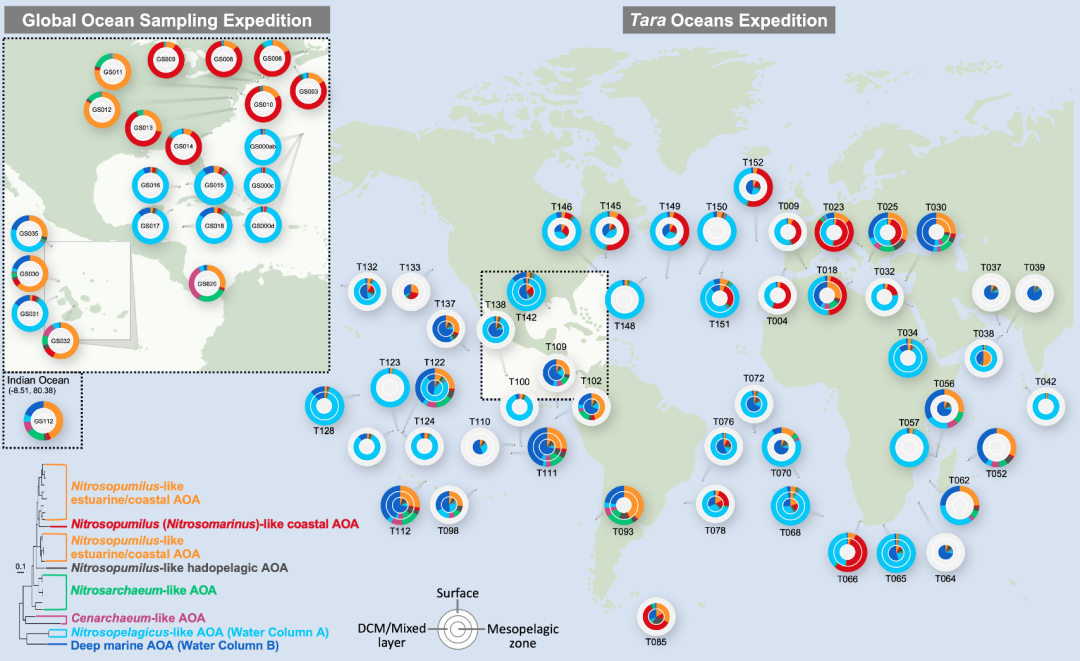
图4. 海洋氨氧化古菌的全球分布图
3. 氨氧化古菌核心功能基因驱动的环境适应性
在功能基因层面,我们从环境压力和营养获取探讨了氨氧化古菌的环境适应机制。我们前期研究发现(Wang B, Qin W, Ren Y et al. ISME J. 2019;13:3067–79)不同海洋氨氧化古菌基因组,包含两种不同类型的ATP酶基因型(A型和V型),其亚基组成和结构存在显著差异。表层海水中的Ca. Nitrosopelagicus-like AOA编码A型ATP酶,而来自深海的WCB-AOA编码V型ATP酶。有趣的是,在深渊hadopelagic AOA同时保留了A型和V型两种ATP酶,可能源于深渊压力和复杂环境的适应性。本研究,我们进一步通过宏基因组技术沿着海洋垂直空间分布,系统研究了AOA的ATP酶分型,发现200m以上水层中AOA以A型ATP酶为主,500m-4000m以V型ATP酶为主(图5)。而4000m-8000m随着hadopelagic AOA相对丰度的逐渐增加,因此A型ATP酶的比例也逐渐增加,这更加充分证明,深海氨氧化古菌通过水平基因转移获得V型ATP酶以适应高渗透压,在高压下通过V型ATP酶泵出过量质子以维持胞内pH稳态。
AMT氨转运蛋白有两类:低亲和力氨转运蛋白和高亲和力氨转运蛋白。深海氨氧化古菌Ca. Nitrosopumilaceae sp. O23和深渊氨氧化古菌Ca. Nitrosopumilus sp. YT1、Mariana trench F8-1、Mariana trench F8-2都没有编码低亲和力氨转运蛋白,他们仅能编码高亲和力氨转运蛋白。在水层垂直空间分布中,仅在200m以上水层能监测到低亲和力氨转运蛋白,200-8000m水层氨氧化古菌均只编码了高亲和力氨转运蛋白(图5)。此发现与我们先前研究报道(Qin W et al. ISME J. 2018;12:508-519)理论一致,虽然模式菌株Nitrosopumilus maritimus SCM1编码两套氨转运蛋白,但低亲和力蛋白在氨浓度降低过程中表达量降低,高亲和力蛋白在低浓度氨条件下表达量增加。表层水中氨浓度相对较高,深层水体氨浓度降到极低,本研究表明不同亲和力氨转运蛋白的基因型和环境氨浓度适应紧密关联。
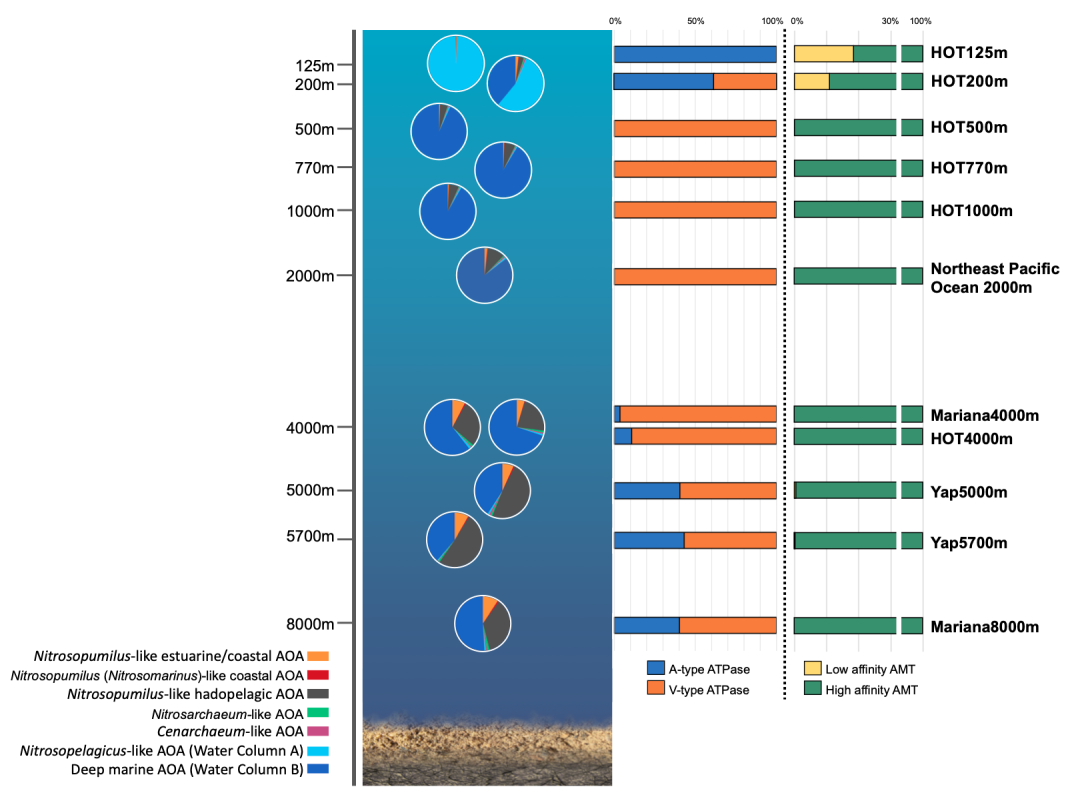
图5. 海洋氨氧化古菌水层垂直空间分布,及其编码ATPase和AMT的功能基因的垂直分布
相比氮利用和碳固定研究,氨氧化古菌的磷代谢的研究较少。氨氧化古菌一般有两套磷酸盐捕获系统:Pst高亲和力磷酸盐转运蛋白和Pit低亲和力磷酸盐转运蛋白。如图6所示,蓝色区域为磷极度缺乏的海域,包括西北大西洋和地中海。通过比对Tara全球海洋宏基因组数据库,氨氧化古菌高亲和力磷酸盐转运的ATP结合亚基PstB在极度缺磷海域的单细胞基因拷贝数远高于其在其他海域的基因拷贝数。同理,低亲和力磷酸盐转运蛋白Pit呈现了与PstB相反的分布格局,在极度缺磷海域,pit单细胞基因拷贝数显著低于其他海域。氨氧化古菌的磷酸盐捕获途径中,在极度缺磷海域主要保留高亲和力磷酸盐转运系统,同时丢失低亲和力磷酸盐转运系统,以减少DNA复制带来的耗能过程。
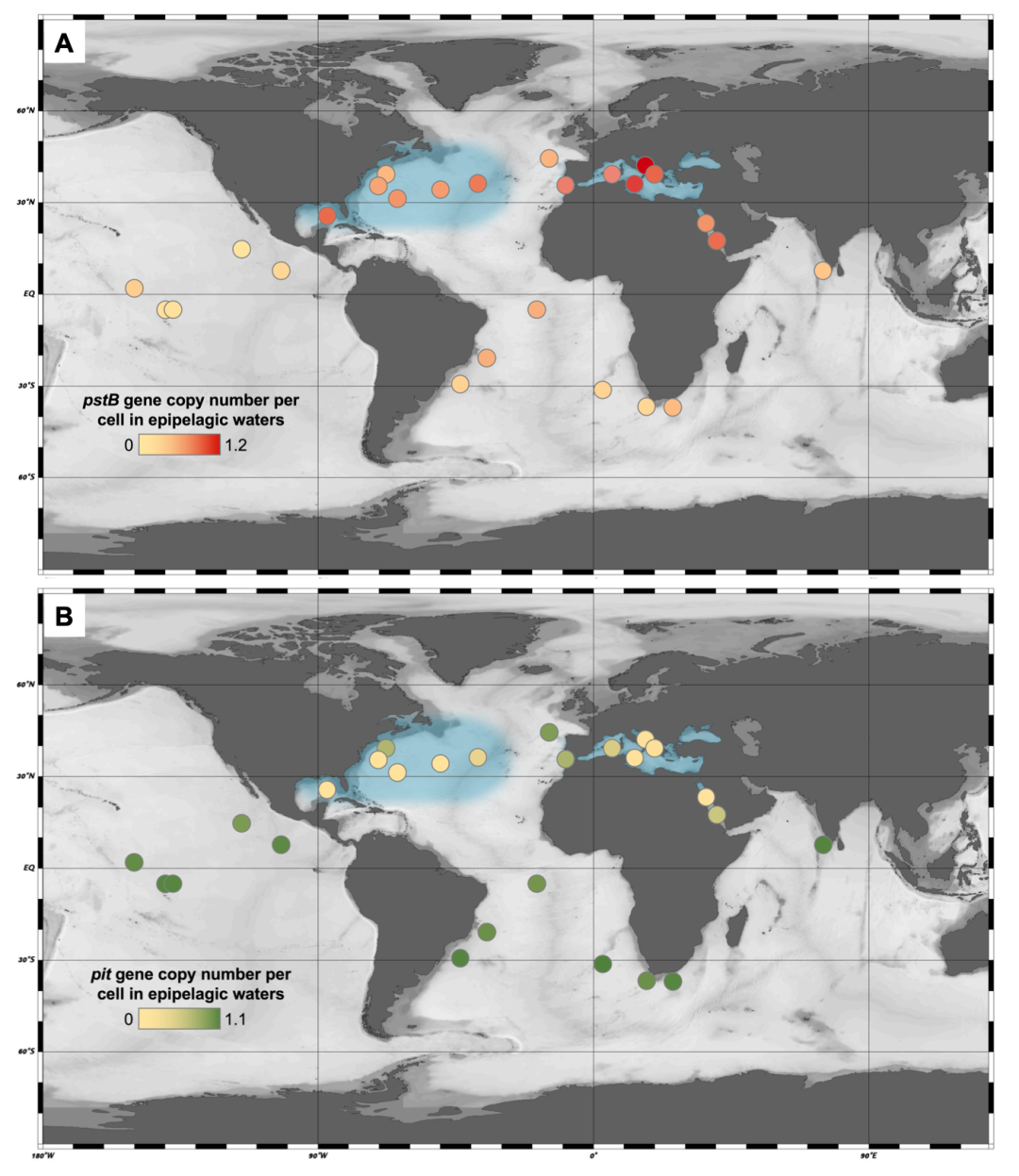
图6. 氨氧化古菌磷酸盐捕获系统的海洋分布特征
(PstB高亲和力磷酸盐转运蛋白,Pit低亲和力磷酸盐转运蛋白)
4. 结论与展望
本研究综合了实验室进化与生理实验和组学大数据挖掘,拓展了我们对氨氧化古菌环境适应机制的认识。通过对于海洋氨氧化古菌基因型与环境因子的关联研究,我们甄别出氨浓度,磷酸盐浓度以及压力为三个主要的环境变量驱动氨氧化古菌在不同海洋生境中的基因型进化和环境适应性。同样,磷的可利用性也被认为是在另外两类重要海洋微生物原绿球藻(Prochlorococcus)和SAR11中磷代谢相关基因型变化的主要环境选择压力。因此,我们的发现进一步论证了营养和能量摄取是海洋中微生物基因型塑造的关键因子。然而,不同的是,原绿球藻(Prochlorococcus)和SAR11主要分布于常温水体环境中,氨氧化古菌的生境跨越了嗜温到嗜热生境以及海洋到陆地系统。我们的研究表明了大量关键功能基因的水平转移和氨氧化古菌生境扩张密切相关,从而形成氨氧化古菌在全球各个生境的广泛适应性。
University of Oklahoma秦玮课题组招聘博士/博后
1、 课题组PI简介
秦玮,美国俄克拉荷马大学(University of Oklahoma),助理教授(Assistant Professor)。
2006-2010,北京师范大学环境科学,学士学位;
2010-2016,美国华盛顿大学(University of Washington, Seattle)环境微生物学,博士学位(导师,美国工程院院士David A. Stahl);
2017-2019,·华盛顿大学海洋学院,博士后研究(Simons Foundation Postdoctoral Fellow);
2020年-迄今,俄克拉荷马大学(University of Oklahoma)微生物与植物生物学系(Department of Microbiology and Plant Biology),助理教授。

作为核心骨干参与完成了多项跨学科交叉科研项目,包括美国自然基金会多维度生物多样性项目(NSF Dimensions of Biodiversity Program),Simons基金会海洋过程与生态学合作研究项目(Simons Collaboration on Ocean Processes and Ecology; SCOPE);参加了4次国际合作远洋科考航次;撰写了Bergey’s Manual of Systematic Bacteriology中“海洋和土壤氨氧化古菌分类学,生理学和生态学”共6个章节;参与了《土壤氮循环实验研究方法》第15章“氮转化过程功能微生物表征方法”的撰写;在国际著名学术期刊PNAS,ISME Journal,Environmental Microbiology, Environmental Science and Technology,Water Research,Limnology and Oceanography上发表学术论文10余篇;受邀在加州理工学院,普林斯顿大学,康奈尔大学等高校做学术报告;担任美国自然基金会(NSF)研究项目评审,以及Nature Communications,ISME Journal,Environmental Microbiology,Microbiome,mBio,Limnology and Oceanography等学术期刊审稿人。曾获得“国家优秀自费留学生奖学金”(2016)、“美国Simons基金会海洋微生物生态学博士后奖学金(Simons Foundation Postdoctoral Fellowship in Marine Microbial Ecology,首位获得该奖学金华人)”(2017-2020) 、“美国大学国家海洋实验室系统首席科学家培训项目奖学金(UNOLS Chief Scientist Training Program Fellowship)”(2019)等。
2、 招聘职位与研究方向
实验室开放若干博士和博士后职位供申请。主要研究方向是环境微生物新物种分离、及其生理代谢机制和基因组学研究。本招聘长期有效,直到职位招满为止。
3、 申请要求
博士:获得生物学、微生物学、环境科学、环境工程,分子生物学、生物信息学等专业学士或硕士学位;英文表达与学术写作能力优异。
博士后:获得环境微生物、微生物学、微生物生态学等专业博士学位,有古菌和硝化微生物生理生态学以及基因组学研究背景者优先;英文表达与学术写作能力优异;以第一作者在学科前沿期刊发表过学术论文。
4、 申请方式
1. 提供英文个人学术简历,包括学习经历、研究经历、发表论文、托福或雅思成绩,博士申请人另需提供GRE成绩;
2. 两页以内的英文个人陈述与研究兴趣介绍;
3. 提供至少3名领域内推荐人的姓名及有效联系方式;
4. 请将以上材料合并为单个PDF,发送至 qinwei2010@gmail.com ,邮件标题请注明:申请博士或博士后职位+本人姓名。
5、 课题组代表论文
1. Qin, W., Amin, S.A., Martens-Habbena, W., Walker, C.B., Urakawa, H., Devol, A.H., Ingalls, A.E., Moffett, J.W., Armbrust, E.V., Stahl, D.A. (2014) Marine ammonia-oxidizing archaeal isolates display obligate mixotrophy and wide ecotypic variation. PNAS 111: 12504-12509.
2. Qin, W., Carlson, L.T., Armbrust, E.V., Devol, A.H., Moffett, J.W., Stahl, D.A., and Ingalls, A.E. (2015) Confounding effects of oxygen and temperature on the TEX86 signature of marine Thaumarchaeota. PNAS 112: 10979-10984.
3. Heal, K.R., Qin, W., Ribalet, F., Bertagnolli, A.D., Coyote-Maestas, W., Hmelo, L.R., et al. (2017) Two distinct pools of B12 analogs reveal community interdependencies in the ocean. PNAS 114: 364-369.
4. Zhang, Y., Qin, W., Hou, L., Zakem, E.J., Wan, X., Zhao, Z., Liu, L., Hunt, K., Jiao, N., et al. (2020) Nitrifier adaptation to low energy flux controls inventory of reduced nitrogen in the dark ocean. PNAS.
5. Qin, W., Amin, S.A., Lundeen, R.A., Heal, K.R., Martens-Habbena, W., et al. (2018) Stress response of a marine ammonia-oxidizing archaeon informs physiological status of environmental populations. ISME Journal DOI:10.1038/ismej.2017.186.
6. Qin, W., Zheng, Y., Zhao F., Wang Y., Urakawa H., Martens-Habbena W., et al. (2020) Alternative strategies of nutrient acquisition and energy conservation map to the biogeography of marine ammonia-oxidizing archaea. ISME Journal.
7. Wang, B.*, Qin, W.*, Ren, Y*, Zhou, X., Jung, M.Y., Lu, L., Heiner, C., et al. (2019) Expansion of Thaumarchaeota habitat range is correlated with horizontal transfer of ATPase operons. ISME Journal doi:10.1038/s41396-019-0493-x. *Joint first author
8. Horak, R.E.A., Qin, W., Schauer, A.J., Armbrust, E.V., Ingalls, A.E., Moffett, J.W., Stahl, D.A., Devol, A.H. (2013) Ammonia oxidation kinetics and temperature sensitivity of a natural marine community dominated by Archaea. ISME Journal 7: 2023-2033.
9. Martens-Habbena, W.*, Qin, W.*, Horak, R.E.A., Urakawa, H., Schauer, A.J., Moffett, J.W. Armbrust, E.V., Ingalls, A.E., Devol, A.H., Stahl, D.A. (2015) The production of nitric oxide by marine ammonia-oxidizing archaea and inhibition of archaeal ammonia oxidation by a nitric oxide scavenger. Environmental Microbiology 17: 2261-2274. *Joint first author
10. Horak, R.A., Qin, W., Bertagnolli, A.D., Nelson, A., Heal, K.R., Schauer, A., et al. (2017) Relative impacts of light, temperature, and reactive oxygen on thaumarchaeal ammonia oxidation in the North Pacific Ocean. Limnology and Oceanography DOI: 10.1002/lno.10665.
11. Zhang S., Qin, W., Xia X., Li, S., Xia L., Zhang L., and Bai Y. (2020) Ammonia oxidizers in rivers of the Qinghai-Tibetan Plateau and their adaptations to high-elevation conditions. Water Research.
猜你喜欢
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature Cell专刊 肠道指挥大脑
系列教程:微生物组入门 Biostar 微生物组 宏基因组
专业技能:学术图表 高分文章 生信宝典 不可或缺的人
一文读懂:宏基因组 寄生虫益处 进化树
必备技能:提问 搜索 Endnote
文献阅读 热心肠 SemanticScholar Geenmedical
扩增子分析:图表解读 分析流程 统计绘图
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
在线工具:16S预测培养基 生信绘图
科研经验:云笔记 云协作 公众号
编程模板: Shell R Perl
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流、快速解决科研困难,我们建立了“宏基因组”专业讨论群,目前己有国内外5000+ 一线科研人员加入。参与讨论,获得专业解答,欢迎分享此文至朋友圈,并扫码加主编好友带你入群,务必备注“姓名-单位-研究方向-职称/年级”。PI请明示身份,另有海内外微生物相关PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。

学习16S扩增子、宏基因组科研思路和分析实战,关注“宏基因组”
 点击阅读原文,跳转最新文章目录阅读
点击阅读原文,跳转最新文章目录阅读
最后
以上就是愤怒唇彩最近收集整理的关于ISME:海洋氨氧化古菌的营养能量策略决定其生物地理学分布格局的全部内容,更多相关ISME:海洋氨氧化古菌内容请搜索靠谱客的其他文章。







发表评论 取消回复